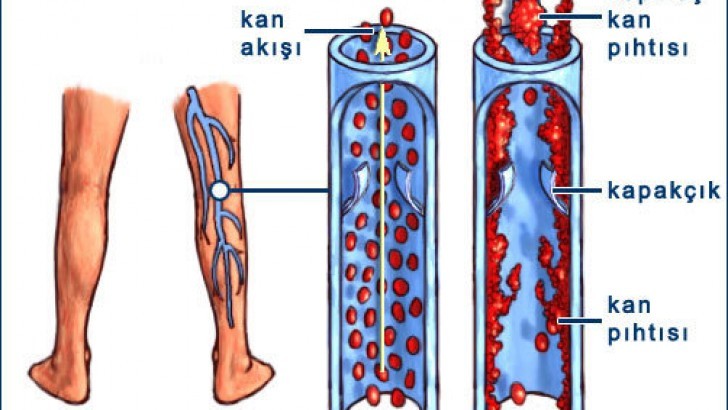
Tromboembolili hastalara yaklaşım anamnez, fizik bulgular ve laboratuar incelemelerinden oluşur. Derin ven trombozunu (DVT) tetikleyen faktörler immobilizasyon, ortopedik ve diğer cerrahi girişimler, oral kontraseptif kullanımı ve gebeliktir. Tekrarlayan venöz trombozlar (trombofili) erken yaşlarda görülebilir, alışılmadık yerlerde (örn., serebral damarlar) oluşabilir veya kalıtsal bir hastalığın işareti olabilen ailevi bir tromboemboli öyküsü ile birlikte olabilir. Buna karşın ediniImiş venöz tromboz riski, hemoliz (paroksismal noktürnal hemoglobinüri ve otoimmun hemolitik anemi), kollajen vasküler hastalıklar ve değişik maligniteler gibi sistemik hastalıklarla birlikte olabilir. Arteryel trombotik hastalık ise daha çok rüptüre olan aterosklerotik plak (örn., koroner arter hastalığı) ve aterotrombotik hastalıkta (örn., iskemik inme) görülür. Trombotik hastalığa klinik yaklaşım, hastalığın yeri (arteryel veya venöz ve hangi damar yatağının tutulduğu) ile damar endotelinde, trombositlerde ve tromboemboliye predispozan olabilecek çözünebilir pıhtılaşma faktörlerinde bir anomali olup olmamasına bağlıdır.
Kan akımında azalma, damar duvarının hasarı ve prokoagülan faktörlerin antikoagülan faktörlere baskın olmasından oluşan virchow triadı trombozun altında yatan fenotipik mekanizmaları tanımlar. Bunlardan ilk ikisi bariz olarak spesifik damar yataklarına lokalize olmakla birlikte, triadın son elemanı sistemik olabilir. Güncel veriler, hemostatik dengenin de damar yatağına spesifik düzenlemelere bağlı olabileceğini göstermektedir. Örneğin antitrombin ILI (AT III), protein C ve protein S’in konjenital eksikliğinde alt ekstremitrelerde DVT görülebildiği halde üst ekstremitelerde DvT görülmez. Buna karşın faktör V Leiden ve protrombin G 202lOA mutasyonu ile ilgili kalıtsal hiperkoagülabilite durumlarında sadece alt ekstremitelerde DvT görülmez; aynı zamanda beyinde de venöz trombüsler oluşur. Sistemik bu faktörlerin dinamik sinyal transdüksiyonu ve damar dokusunun mikroçevresi ile karşılıklı etkileşimlerinin hiperkoagülabilitedeki bu farklılıkları düzenlemesi olasıdır. Damar dokusundaki hemostatik regülasyon aşağıdaki değişik faktörler tarafından ayarlanır: 1 Trombomodulin, doku faktörü ve nitrikoksid sentetaza endotel hücresinin (EC) ekspresyonunu etkileyen yoksunluk stresi gibi mikro-çevresel faktörler; 2. Endotel hücresi alt tipine özgü sinyaller (ör: yoksunluk stresi aortta nitrikoksid sentetaz aktivitesini arttırmasına karşın pulmoner arterde bunu yapmaz); 3. Von Willebrand faktör (vWF) gibi proteinlerin transkripsiyonel regülasyonundaki farklılıklar.
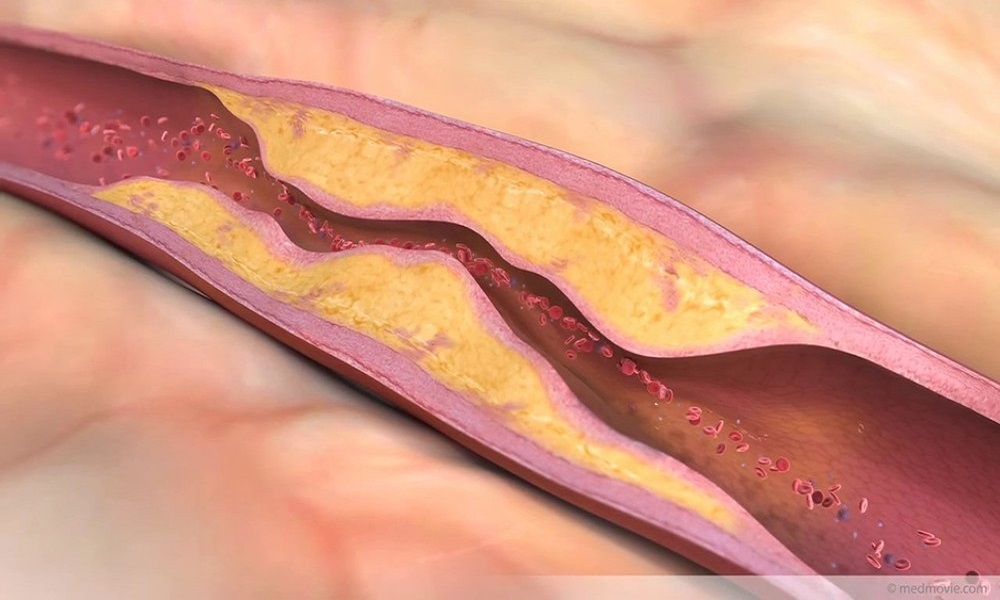
Aterotrombotik hastalığın oluşmasında, hemostazın endotel hücresi (EC) intrensek regülasyonuna ek olarak, (EC)’ leri n fibrinolitik sistemde karşılıklı etkileşimleri önemlidir. Doku tipi plasminojen aktivatörünün (t-PA) endotel hücresinden salımmındaki eksiklik hastalarda, özeııikle koroner arterlerde tromboz için predispozan bir faktör olabilir. Örneğin t-PA’sl düşük kardiyak aııograftlarda koroner arter tıkanma insidansı normal t-PA’lı aııograftlara göre daha yüksektir. Kardiyopulmoner by-pass sırasında antifibrinolitik etkisine bağlı olarak kan kaybını azaltan aprotinin, by-pass’tan sonra venöz graft tıkanması ve miyokard enfarktüsü riskini arttırır. Her ne kadar kardiyovasküler risk faktörleri plasminojen aktivatör inhibitörü i (PAl-I) sentezini
etkileyebilirse de, artmış PAI-l düzeyinin aterosklerotik hastalık veya koroner olayları riskini arttırıp arttırmadığı tartışmalıdır. Ancak bu durumun anjiyoplasti sonrası geç restenoza neden olduğu bilinmektedir.Bu aterotromboz ile ilişkili olan bir hastalıktır. Sistationin sentetaz eksikliği gibi homosistinüri ve ciddi hiperhomosistinemi ile seyreden nadir konjenital sendromlarda görülen çok yüksek plazma homosist(e)in (HCY) düzeylerinin tromboemboli ile erken ve ağır ateroskleroza neden olduğu uzun süreden beri bilinmektedir. HCY, ECiere hasar verebilir veya ECierin normal antikoagülan fonksiyonunu azaltabilir. Ancak çalışmalar genel popülasyonun yaklaşık %5 inde görülen hafif bir HCY yüksekliğinin bile koroner, periferik ve serebral arter hastalığını arttırdığını göstermektedir. Plazma HCY düzeyleri açlık veya metionin yüklemesi sonrası ölçülebilir. Kanıtlar her iki ölçümün de önemli olduğunu ve remetilasyon siklüsü ile trans-sülfürasyon yolunun bozukluklarını işaret ettiğini göstermektedir. Hafif dereceli HCY yüksekliği sıklıkla N5, NIO-metilen tetrahidrofolat (MTHF) redüktaz enziminin termolabil bir formuyla bağlantılıdır. Bu protein MTHF bağlanma yerinin kodlanma bölgesindeki noktasal bir polimorfizmin (C677T) sonucudur. Bu mutasyon genel popülasyonun %30-40’ında olup, orta dereceli bir HCY yüksekliği ile birliktedir. Bu polimorfizm bakımından homozigot olan kişilerde HCY düzeyleri daha da yüksektir. Ayrıca eğer bu kişiler göreceli bir folat yetersizliği içindeyseler HCY düzeyinin yüksekliği daha da olasıdır. Aslında HCY metabolizmasının ko-faktörü olan vitaminIerden (folat, B6 ve B 12 vitaminieri) herhangi birinin eksikliği hafif bir homosist(e)inemiye neden olabilir. B6, BI2 vitamini ve folat verilerek HCY düzeyinin düşürülmesi büyük olasılıkla, hafif derecedeki HCY yüksekliğinin nedeni ne olursa olsun, buna bağlı aterotrombotik riski azaltmanın en etkili tedavisidir.
Kuzey Amerika’da yapılan çalışmalarda, MTHFR C677T mutasyonu ve hafif hiperhomosist(e)inemi ile artmış venöz tromboembolizm (VTE) riski arasında anlamlı bir ilişki saptanmamış olmasına karşın, diğer uluslararası çalışmalarda zayıf bir ilişki saptanmıştır. Her ne kadar yukarıdaki ECye bağlı anomaliler belirgin şekilde hemostazı etkilerse de, trombosit aktivasyonu ve adezyonu özellikle miyokard infarktüslü, kararsız anjinalı ve iskemik inmeli hastalarda, aterotrombozun oluşumunda önemlidir. Buna ek olarak koroner revaskülarizasyondan sonra damarların açık kalabilmesi için akut ve kronik antitrombosit tedaviler primer yöntemlerdir. Antitrombositer tedavi aşağıdaki spesifik trombosit fonksiyonlarını hedefleyebilir: 1. Siklo-oksijenaz kaynaklı tromboksan A2 formasyonu 2. Adenozin difosfat’ın(ADP) kendisine ait trombosit reseptörü ile etkileşimi 3. Agregasyon için gerekli olan glikoprotein I1blIIla( GPIIb/IIIa)- fibrinojen birleşmesi. Aspirin uzun zamandan beri miyokard enfarktüsü, anjina ve inme tedavisinin ana elemanıdır. Aspirin trombosit siklo-oksijenazını geri dönüşümsüz olarak inhibe eder ve tromboksan A2 salınımı bloke olur. Aspirin, zayıf fizyolojik agonistlere trombosit agregasyonunu etkili şekilde bloke eder; ancak trombositlerin trombin ve kuvvetli agonistlerce uyarılmasını kısmen inhibe edebilir. Böylece arteryel tromboz riski olan hastaların tedavisinde tromboksan A2 dışındaki trombosit aktivasyonu yollarının da blokajı önem kazanmıştır. İnme ve koroner arter hastalığı tedavisinde kullanılan bazı ilaçlar spesifik olarak trombosit ADP reseptörünün pıhtı ortamındaki ADP ile etkileşmesini bloke eder ve böylece lokal olarak salgılanan ADP’nin diğer trombositleri aktive etmesini önleyerek trombosit ayrışmasını durdurur.
Tienoprimidin türevIeri olan tidodipine ve dopidogrel ADP’nin uyardığı trombosit etkisini metabolitleri aracılığı ile antagonize ederek ADP’nin, trombosit ADP reseplörüne bağlanmasını bloke eder. Her iki ilaç da trombosit fonksiyonunu ileri derecede inhibe eder ve aspirinin oluşturduğundan daha uzun kanama zamanına neden olur. Her iki ilaç da aspirin ile kombine olarak iskemik inmeyi ve revaskülarizasyondan sonra stent trombozunu bloke etmede etkili olmakla birlikte tidodipinin hematolojik yan etkileri göz önünde tutulmalıdır. Trombosit aktivasyonunu bloke etmenin üçüncü bir yolu da primer trombosit reseptörünün ligamanları olan fibrinojen ve vWF’ün, GPllbllIla’ya bağlanmasını hedefler. GPllbllIla inhibitörlerinin ilklerinden biri modifiye monoklonal antikor olan abciximabdır. Bu ilaç GPIIblIIla’nın fibrinojene bağlanmasını önler ve trombosit agregasyonunu bloke eder. Abciximab anjioplasti, stent takılması ve farmakolojik tromboliz sonrası restenozu önlemede başarılı olmasının yanı sıra infarktüsün yayılmasını bloke etmekte ve kararsız anjinanın tedavisinde de etkilidir. Diğer GPIIb/IIIa blokerleri (ör: Eptifibatide [İntegrilin) ve tirofiban[Aggrastat)) GPllbllIla arjinin-glisin-aspartat (RGD) bağlanma yerlerini etkileyerek akut koroner olayların tedavisinde başarılı olurlar. Koroner arter hastalığı riski olan hastalarda bu gibi blokerlerin başarılı kullanımı trombosit reseptörü-ligand etkileşiminin trombüs oluşumundaki önemini daha da belirginleştirmektedir. Halen bu GPIIb/IIIa inhibitörlerinin kararsız anginalı ve akut miyokard enfarktüslü hastalarda akut i.v. kullanımı ve revaskülarizasyondan sonra da damarların açık kalması için kullanım endikasyonu vardır. Tüm GPIIb/IIIa inhibitörlerinin kullanımında trombositopeni seyrek «%2) bir komplikasyon olup, büyük olasılıkla bağışıklığa bağlı trombosit harabiyetine ve neo-epitopların reseptöre sunulmasına bağlıdır. Trombosit transfüzyonu yapılarak veya yapılmadan ilacın vücuttan temizlenmesi tipik olarak i hafta içinde trombositopeninin ortadan kalkmasını sağlar. Oral anti-GPIIb/IIIa formülasyonlarının yaygın olarak kullanılmamasının nedeni, kısmen trombositopeni insidansını arttırmasıdır. GPIIb/lIIa’nın trombositlere bağlı aterotromboz için önemli olmasının yanı sıra spesifik bir trombosit GPIIb/ IIIa aHotipi olan P i(A2) koroner trombozu için bir risk faktörü olarak son zamanlarda ortaya çıkmıştır. Çalışmalar GPIIIa molekülünün PI(A2) aHotipinin, hem miyokard infarktüsü hem de kararsız anjinanın insidansında bir artışa ve kardiak cerrahiden sonra koroner ve serebral hasara neden olduğunu göstermiştir. Danimarka’da yapılan büyük ve uzun süreli bir çalışma, PI(A2) aHotipi bakımından homozigot olan erkeklerde miyokard enfarktüsü riskinin 3-4 kat fazla olduğunu göstermiştir. Mevcut kanıtlar PI(A2) ve tromboz ile ilgili diğer trombosit reseptör aHotiplerinin agonistlere ve yoksunluğa trombosit yanıtını arttırdığını düşündürmektedir.
Doğal olarak bulunan antikoagülanların kalıtsal eksikliği olan hastalarda trombin oluşumu ve antikoagülan yolları arasındaki denge geniş olarak araştırılmıştır. Bu hastalarda venöz tromboz ve pulmoner emboli (PE) görülme olasılığı yüksektir. DVT’ye neden olan kalıtsal hastalıklar içinde en sık görüleni faktör V’in Leiden mutasyonudur. Genel po-pülasyonun yaklaşık %5’i faktör V Leiden için heterozigottur. Faktör V mutasyonu aktive protein C (APC)'nin eklendiği ve normal faktör Va (Arg 506)'1 inaktive ettiği bölgede olur; bu ek bölgesinin ortadan kalkması APC direncine neden olur. Mutant faktör Va’nın inaktive olmaması protrombinaz kompleksinin inhibe olmamasına neden olarak trombin yapımının artmasına ve trombofilik bir fenotipe neden olur. Heterozigot faktör V Leiden kalıtımı DVT veya PE riskini yaklaşık 5 kat arttırır. Ilk kez DVT veya PE görülen olguların yaklaşık dörtte birinde heterozigot faktör V Leiden mutasyonu vardır. Tekrarlayan DVT atakları olan veya ailesinde sık DVT görülen popülasyonda bu oran %60’a yaklaşır. APC direnci, ortama APC katılmasının parsiyel tromboplastin zamanını (PTT) yeterince uzatmamasına dayanan özel bir pıhtılaşma testi ile gösterilir. Genotipleme ile faktör V Leiden allelinin varlığı ve heterozigot mu homozigot mu olduğu saptanır. Faktör V Leiden hiperkoagülabilite bakımından zayıf bir risk faktörüdür. Heterozigot faktör V Leiden mutasyonu olan 50 yaşındaki hastaların % 25’inde DVT veya PE görülmesine karşın diğer kalıtsal trombofililerde bu oran çok daha yüksektir. Buna ek olarak faktör V Leiden’li kişilerde DVT veya PE tipik olarak immobilizasyon, gebelik veya oral kontraseptif kullanımı gibi edinsel risk faktörleri ile birliktedir. Bazı yayınlarda homozigot faktör V Leiden’li kişilerin ileri yaşlara kadar asemptomatik kaldıkları bildirilmiş ise de genelolarak normal faktör V’li kişilere göre bunların DVT riski 90 kat fazladır. Buna ek olarak bazı olgularda Leiden mutasyonu olmadan da APC direnci görülmüştür. Faktör V Leiden’den çok daha nadir olan faktör V Cambridge’de de APC ek bölgesinde (Arg 306) benzer bir mutasyon görülür. Bu mutasyon APC direnci ve tromboz ile bağlantılıdır. Artmış APC direnci ve tromboz ile seyreden başka faktör V defektIeri de tanımlanmıştır. Lupus antikoagülanlarının varlığı, kanser, gebelik, hormon replasman tedavisi ve oral kontraseptif kullanımı edinsel APC direncinin nedenleridir.
Kalıtsal trombofili ile ilgili başka bir mutasyon da protrombin G 20210A mutasyonudur. Bu olay protrombin geninin 3’ dönüştürülmemiş bölgesinde olur ve normalden daha yüksek protrombin düzeylerine neden olarak DVT veya PE riskini yaklaşık 2 kat arttırır. Heterozigot mutasyon Avrupa popülasyonunun yaklaşık % 3’ünde mevcuttur. Bu mutasyon protrombin molekülünün fonksiyonunda bir değişiklik yapmaz ve artan protrombin düzeyleri sağlıklı insanlarda görülen düzeylerden anlamlı bir farklılık göstermez. Bu nedenle bu protrombin mutasyonunun trombin oluşumunu ne şekilde etkilediği halen tam olarak bilinmemektedir. Ancak protein S aktivitesİ üzerine inhibitör bir etkisi olduğu ve artmış trombin tarafından aktive edilebilir fibrinoliz inhibitör (TAFİ) aktivİtesi nedeniyle azalmış fibrinolitik etkiye yol açtığına yönelik bazı kanıtlar vardır. G20210A genotip tanısı bu spesifik mutasyonun DNA analizİ yapılarak konulur.
Doğal antikoagülanların (ATIIl, protein C ve protein S) eksikliği, faktör V Leiden ve protrombin G2021OA’ya göre daha seyrektir. Ancak bunların eksikliğinin daha genç yaşlarda semptomatik venöz tromboz oluşturma olasılığı fazladır. Bu eksikliklere bağlı olarak görülen trombozların yalnızca yaklaşık yarısında gebelik, cerrahi girişim veya immobilizasyon gibi edinsel risk faktörleri vardır. Bazı mutasyonlar faktör düzeylerini azalttığından, bazı mutasyonlar ise disfonksiyonel proteinler oluşturduğundan; ATIlI, protein C ve S eksiklikleri hem fonksiyonel hem de antijenik yöntemlerle belirlenmelidir. ATIlI, protein C ve S eksikliği toplam DYT’li ve/veya PE’li olguların %5-1O’undan daha azında bulunur. ATIli doğalolarak bulunan bir antikoagülan olup, endojen heparin sulfat ile kompleks oluşturarak hem oluşmuş trombini hem de faktör Xa’yı inhibe eder. Heterozigot ATIlI eksikliği, ATIlI düzeyinde %50’den çok azalmaya neden olur ve özellikle venöz dolaşırnda tromboz oluşturur. Ancak ATIlI’ün heparine bağlanma yerinde homozigot mutasyon olanlarda arteryel tromboz görüldüğü de bildirilmiştir. Heterozigot hastaların %50’sinde 25 yaşına kadar tromboz görülür. ATIIl’ün moleküler ağırlığı düşük olup nefrotik sendromda proteinüri ile kaybı sonucu semptomatik edinsel ATIlI eksikliği görülür. Edinsel ATIlI eksikliği (aynı zamanda protein C eksikliği) kök hücre naklinden sonra ağır hepatik veno-okluzif hastalığa bağlı olarak da görülebilir. Araştırıcılar hasar görmüş hepatik mikrovaskülatürde ATIIl ve protein C’nin tüketildiğini ileri sürmüşlerdir. Heparin ile birlikte veya heparinsiz ATIlI replasmanı, trombosit tüketimini azaltarak ve kök hücre transplantasyonundan sonra görülen veno-okluzif hastalıkta oluşan sıvı bozukluklarını düzelterek faydalı olmaktadır. Heterozigot ATIlI eksikliği olan semptomatik hastaların tedavisinde genellikle heparinle birlikte plazma verilerek yapılan kısa süreli ATIlI replasmanı başarılı olmuştur. Bu hastaların uzun süreli tedavisinde primer olarak varfarin kuııanılır. EC yüzeyindeki trombin ve trombomodulin kompleksi protein C’yi aktive eder; APC, ko-faktörü olan protein S ile birleşerek, faktör Ya ile Yılla’ya eklenir ve bunları inaktive eder. Bu olaylar protrombinaz ve tenaz komplekslerini baskılayarak trombin oluşumunu yavaşlatır.
ATIIl eksikliğine benzer olarak heterozigot protein C ve S eksikliğinde de erken yaşta (ortalama 20-40) venöz ve bazen de arteryel tromboz görülür. Homozigot protein C eksikliği yenidoğanda purpurafulminansa neden olur ve yaygın venöz tromboz ile cilt nekrozu oluşturur. Benzer klinik tablo erişkinlerde eş zamanlı heparinizasyon yapılmadan varfarin tedavisi başlandığı zaman bildirilmiş ve varfarine bağlı cilt nekrozu adı verilmiştir. Bu hastaların yaklaşık 1/3’ünde kalıtsal protein C eksikliği varken geri kalan bireylerde edinsel protein C eksikliği görülür. Varfarin, K vitaminine bağlı protein C sentezini inhibe eder ve bu faktörün yarı ömrü kısa olduğundan, prokoagülan faktörler olan faktör Il, IX ve X düzeyi düşmeden protein C düzeyi hızla düşer. Bu dengesizlik varfarin başlandıktan kısa bir süre sonra prokoagülan bir durum yaratır ve yaygın mikrovasküler trombozla sonuçlanır. Her ne kadar kalıtsal veya edinsel protein C eksikliği oldukça nadir ise de bir çok klinisyen venöz trombozu olan hastalara varfarin tedavisi başlanmadan önce, heparinle (fraksiyone olmayan heparin [UFH] veya düşük molekül ağırlıklı heparin [LMWH]) tam bir antikoagülan tedavi uygulanmasını tercih eder. Kalıtsal protein S eksikliğinde de yine benzer şekilde varfarin’e bağlı bir cilt nekrozu görülür. Akut hastalıklarda da protein S eksikliği edinilebilir. Protein S dolaşırnda serbest şekilde bulunur ve C4b-bağlayıcl proteine bağlanır. Sadece serbest protein S, protein C’nin aktif bir ko-faktörüdür. C4b-bağlayıcı protein bir akut faz reaktanıdır ve ciddi hastalıklarda serbest protein S düzeyi düşmeden C4b düzeyleri yükselir. Benzer bir durum normal gebeliklerde görülür. Homozigot veya şüpheli heterozigot protein C veya S eksikliğinin akut tedavisinde, özellikle neonatal purpura fulminans varlığında, tam doz heparin antikoagülasyonu ile birlikte plazma veya protein C konsantresi kullanılır. ATIlI eksikliğinde olduğu gibi, protein C veya S eksikliğinin kronik tedavisinde de varfarin kullanımı başarılıdır. Başka bir doğal antikoagülan olan doku faktör yolu (pathway) inhibitörü (TFPİ) eksikliği de artmış DVT riski ile birliktedir. Bölüm 51’de tartışıldığı gibi TFPİ, doku
faktörü- VIIa-tenaz kompleksini inhibe eder. TFPİ düzeyini saptayacak laboratuar yöntemleri henüz yaygın olarak kullanılmamaktadır.
Birçok medikal ve cerrahi hastalık tromboz riskini arttırır. Bu edinsel risk faktörlerinin hangi fizyopatolojik mekanizmalarla tromboza neden oldukları bir çok durumda bilinmemektedir. Cerrahi girişimler (özellikle ortopedik) ve travma dahilolmak üzere bu risk faktörlerinin çoğu immobilizasyon ve buna bağlı alt ekstremite kan akımında staz ile bağlantılıdır. Tromboz kanıtları ayrıntılı bir şekilde araştırıldığında, cerrahi girişim ve travma sonrası DYT insidansının çok yüksek (>%50) olduğu görülür. Cerrahi girişimden ve travmadan sonra immobilizasyon dışında yağ embolisi ve doku harabiyeti gibi diğer fizyopatolojik faktörler de DVT riskini arttırır. Doku harabiyeti özellikle masif doku faktörü salınımına neden olan kapalı kafa travmalarından sonra önemli bir risk faktörüdür. Travma geçiren hastalarda kanama tehlikesi nedeniyle antikoagülan tedavinin kontrendike olduğu yüksek riskli grupta PE’yi önlemek için, bazı merkezlerde profilaktik (ve bazen geçici) vena cava (IVC) filtreleri kullanılmıştır. Atrial fibrilasyona bağlı sol atriumda oluşan staz da tedavi edilmeyen hastalarda sistemik tromboembolinin (genellikle inme) başka bir kaynağıdır.
Hem gebelik hem de oral kontraseptif kuııanımı genel olarak DVT ve PE riskini arttırır. Oral kontraseptif kullanan kadınlarda heterozigot faktör V Leiden de varsa bu risk daha da artar. Ayrıca oral kontraseptif kullanan kadınlarda sigara içimi tromboz riskini anlamlı olarak arttırır. Bu artışın kısmen artmış tromboksan sentezine bağIi trombosit reaktivite artışından olduğu düşünülmektedir. Epidemiyolojik kanıtların sigara içiminin ana kardiyovasküler risk faktörü olduğunu göstermesinin yanında, oral kontraseptiflerin östrojen ve progestin komponentierinin de riski arttırdığı saptanmıştır. Üçüncü jenerasyon kontraseptifler de tromboz riskini ortadan kaldırmamıştır. Daha önce belirtildiği gibi hem gebelikte hem de oral kontraseptif kullanımında edinsel protein C direnci görülebilir ve ayrıca gebelik sırasında hem serbest hem de fonksiyonel protein S düzeyleri düşebilir. Bu durumda hiperhomosist(e)inemi gibi tromboza ait ek risk faktörlerinin bir rolü olup olmadığı bilinmemektedir.
Nefrotik sendromda görülebilen trombozun böbreklerden ATIlI kaybına bağlı olması olasıdır. Yapay kalp kapağı, orak hücreli anemi ve diğer hemolitik anemiler gibi başka protrombotik durumlar ise muhtemelen kan hücrelerinin prokoagülan membran fosfolipidlerine fazlaca maruz kalmasına bağlı yıkım yoluyladır. Heparinin oluşturduğu trombositopeni ile trombotik trombositopenik purpurada, trombosit aktivasyonu ve klirensinin primer protrombotik belirtiler olduğu düşünülmektedir. Tromboz ile ilişkili miyeloproliferatif hastalıklarda sıklıkla trombosit fizyolojik mekanizmalarında anormallikler (hiperagregabilite) mevcuttur. Her ne kadar bazı malign hastalıklarda kronik yaygın damar’içi pıhtılaşma var ise de (Trousseau sendromu), genellikle malignitelerdeki artmış olan DVT ve PE riski buna bağlı değildir.Edinsel protrombotik hastalıklardan bir başkası antifosfolipid antikor (APA) sendromudur. APA sendromu primer olarak görülebilir veya sistemik lupus eritematozus gibi başka bir otoimmun hastalığa sekonder de olabilir. APA sendromunun tüm belirtileri hiperkoagülabiliteye bağlıdır. Bunlar tekrarlayan venöz veya arteryel trombozlar, trombosit klirensine bağlı trombositopeni ve plasental damar yetersizliğine bağlı tekrarlayan düşüklerdir. APA sendromunun serolojik belirteçIeri antikardiolipin antikorları ve/veya lupus antikoagülanıdır. Antikardiolipin antikorlan genellikle ELİsA ile saptanırken, lupus antikoagiilanlan fosfolipid bağımlı pıhtılaşma testleri ndeki (protrombin zamanı, PTT veya Russel’ın viper venom pıhtılaşma zamanı) uzama ve ortama fosfolipid eklenmesinin bu testleri düzeltmesi ile saptanır. Bu nedenle lupus antikoagiilanı aslında yanlış bir adlandırmadır, çünkü varlığında hastalarda kanama değil pıhtılaşma riski artmıştır. Bu adlandırmanın başka bir yanıltıcı yanı da fosfolipid-reaktif antikorların aslında plazmadaki f3rglikoprotein (f3rGPI) ve protrombin gibi fosfolipid bağlayıcı proteinlere yönlenmiş olmasıdır. Buna ek olarak antikorlar (özellikle immunoglobulin G ve aynı zamanda immunoglobulin M veya A) direkt ve spesifik olarak f3r GPI’ye ve belki de protrombine yönlendiğinde tromboz riski muhtemelen çok artmıştır.
Esansiyel trombositopeni, kronik myeloid lösemi ve polisitemia vera tam (esansiyel trombositopeni) veya kısmen (kronik myeloid lösemi ve polisitemia vera) trombosit artışı ile karakterizedirler. Bunlara primer trombositoz adı verilir. Bu hastalıklarda trombosit agregasyon ölçümünde, özellikle zayıf agonistler olan epinefrin veya ADP’ye karşı anormal bir yanıt saptanır; ancak bu anormal yanıt kanama riski ve tromboz riskine tam bir uyum göstermez. Miyeloproliferatif hastalığı olan kişilerde tromboz riski artmıştır. Polistemia veralı hastalarda mezanterik, portal ve hepatik venöz dolaşımda tromboz insidansı fazladır. Esansiyel trombositozda genç hastalarda bile, arteryel ve venöz trombotik komplikasyonlar görülür. Ancak miyeloproliferatif hastalığı olan kişilerin hangisinde tromboz olacağını gösteren klinik bir risk faktörü yoktur. Özellikle 106/,L’den daha fazla olan trombosit sayısının tromboz riskini arttırdığı düşünülmektedir. Kanıtlar trombositozdaki artmış trombosit dönüşümünün (turnover) tromboembolik komplikasyonlarla bağlantılı olduğunu göstermektedir. Bu durum radyoaktif trombosit sağkalı m çalışmaları ve tromboz ile ilgili retiküle trombositlerin oranındaki artıŞ ile gösterilmiştir. Miyeloproliferatif hastalığı olan kişilerde antitrombositer ajanlar kanamaya neden olabilir; bu nedenle ancak eritromelalji gibi semptomatik trombozu olan hastalarda aspirin endikasyonu vardırSemptomatik hastaların aspirin ile başarılı tedavisi trombosit klirensini azaltarak trombosit sağ kalım süresini uzatır. Trombositozun trombotik komplikasyonlarını önleyici diğer tedaviler anagrelide veya hidroksiüre ile trombosit sayısını düşürmektir. Arteryel tromboz bakımından yüksek risk altında bulunan esansiyel trombositemili hastaların en etkin tedavisinin hidroksiüre ve düşük doz aspirin kombinasyonu olduğu yönünde bazı kanıtlar vardır. Fe eksikliği anemisi, kronik enfeksiyon, romatoid artrit veya splenektomi sonrası gibi durumlara bağlı reaktif (sekonder) trombositozu olan hastalarda genel olarak trombotik risk anlamlı bir artış göstermez.
Özellikle 50 yaşın altında olan, açıklanamayan DYT’si bulunan ve ailesinde venöz tromboz öyküsü olan kişilerde tekrarlayan YTE, trombofilinin nedenlerinin araştırılması için laboratuar testlerinin yapılmasına dair güçlü bir endikasyondur. Bu hastalarda tekrara neden olabilecek bütün kişisel risk faktörleri belirlenmeli, ailevi danışmanlığagerek duyulabilecek kalıtsal hastalıklar da araştırılmalı trombofilinin değerlendirilmesinde kullanılan yöntemler şunlardır: 1. Dilue faktör ,v metodu kullanılarak APC direncinin belirlenmesi, 2. Protrombin G 20210 A için genotipleme, 3. Lupus antikoagülan assay ve antikardiyolipin antikorları, 4. Fonksiyonel ATIlI düzeyi ve 5. Fonksiyonel protein C ve S düzeyleri (tablo 53-4). APC direnci varlığında faktör YLeiden’in gerçekten bulunup bulunmadığını saptamak için faktör YLeiden genotiplemesi yapılmalı ve hastanın homozigot mu yoksa heterozigot mu olduğu araştırılmalıdır. Eğer kişi lupus antikoagülanları veya antikardiyolipin antikoru bakımından pozitif ise APA sendromunu doğrulamak için spesifik olarak GPİ’ye karşı olan antikorlar araştırılmalıdır. Aterotromboz ile arteryel tromboembolizmin oluşumu ve değerlendirilmesinde laboratuvar testlerinin kullanımı net değildir. HCY düzeyinin yüksekliğinin saptanması önemlidir. Bu durumda spesifik tedavi (folat, vit B6 ve vit B12) endikasyonu vardır. Bugün için mevcut olan laboratuvar testleri ile arteryel ve venöz tromboz için trombositlere spesifik risk faktörleri yeterince saptanamamakta veprognoza dair bir öngörüde bulunulamamaktadır. Bu nedenle trombosit agregasyon testleri ve trombosit reseptör allotipinin araştırılması rutin olarak endike değildir. Miyeloproliferatif hastalık varlığında trombosit sayısı ve agregasyonu ile trombosit kapanma zamanları bugün için elimizde olan yegane yararlı testlerdir. Tekrarlayan trombozu olan veya aile anamnezinde bu tür hastalar bulunan kişilerde daha nadir hastalıklar aranabilir. Bu durumda düşük t-PA düzeyleri, yüksek PAI-] düzeyleri, disfibrinojenemj (uzamış trombin veya reptilaz zamanı) ve düşük plazminojen düzeyleri için testler yapılabilir. Bunların tümü bir hemostaz uzmanı ile konsülte edilerek yapılmalıdır.
Ortopedik girişimler veya postoperatif uzun süreli immobilizasyon süresine gerek duyulacak büyük operasyonlar gibi artmış venöz tromboz riskine maruz kalacak olan hastalarda DVT proflaksisi yapılmalıdır. Proflaktik tedavi alt ekstremiteye aralıklı basınç uygulamak ile düşük doz UFH veya LMWH ile yapılan farmakolojik tedaviden oluşur. Tromboemboli tanısı konulduğu zaman derhal tedaviye başlanmalıdır. Yenöz trombozu olan hastaların çoğunda, kısa süreli heparin tedavisi ve uzun süreli varfarin kullanımı ile antikoagülasyon yapılır. Yaygın proksimal venöz pıhtısı olan veya PE bulunan hastalarda trombolitik tedavi endikasyonu vardır. Antikoagülasyon kontrendikasyonu olan, antikoagülasyon
komplikasyonu (genellikle aktif kanarna) bulunan veya antikoagülasyonun başarısız olduğu (tekrarlayan PE) hastalarda inferior vena cava (lVC) filtreleri kullanılır. IYC filtreleri erken PE insidansını belirgin şekilde azaltır ancak bunların kullanımında da tromboz ve geç komplikasyon olarak IVC trombozu ile %10-20 oranında post-flebitik sendrom görülebilir. Eş zamanlı düşük doz antikoagülasyonun bu komplikasyonları önleyip önIemediği bilinmemektedir. Travma olgularında geçici IYC filtreleri sık olarak kullanılmaktadır. Bunların kullanılma süreleri 7-10 gün ile sınırlı kaldığında çok daha etkin olmaktadırlar. Düşük maliyeti, izleme kolaylığı ve kısa yarılanma ömrü nedeni ile birçok uzman tarafından halen UFH en çok tercih edilen tedavidir. Heparin 80 U/ kg intravenöz bolus olarak başlanır, 18 U/kg/h olarak sürekli infüzyon halinde devam edilir. Tekrarlayan trombozu önlemede 30 000 U/gün’ün üzerindeki heparin dozlarının çok etkili
olduğu gösterilmiştir. Heparin PTT ile izlenir. Heparin tedavisi esnasında terapötik PTT düzeyi hastanın başlangıç PTT düzeyinin 1.8-2.5 katıdır. Bu PTT aralığı 004-0.7 U/mL olan terapötik anti-Xa düzeylerinin karşılığıdır. Heparin infüzyonu hastanın ağırlığına ve PTT düzeyine göre ayarlanmalıdır; heparinin yarılanma ömrü kısa olduğundan (yaklaşık 4 saat) infüzyona kısa bir süre ara verilmesi bile PTT’nin normale dönmesine neden olabilir. UFH’ya en az 4 gün devam edilmelidir (büyük pıhtılı hastalarda daha uzun). Hastalar varfarin ile tam olarak antikoagüle edildikten sonra (intemasyonal normalize ratio [INR] =2 birbirini izleyen iki gün) heparin kesilebilir. Bazı hastalar yüksek doz (genellikle> 40 000 U/ gün) heparin almalarına rağmen

PTT terapötik düzeye gelmez. Bu heparin direnci gerçekheparin düzeyi ile (anti-Xa aktivitesi olarak ölçülür) PTT’nin dissosiyasyonundan kaynaklanır. Heparin direncinde anti-Xa düzeyinin izlenmesi endikedir. Heparin direnci nadir olarak ATIII eksikliğine bağlıdır; daha çok faktör VIII’in ve heparin bağlayıcı proteinlerin artışı nedeni ile enflamatuar hastalığı bulunan kişilerde görülür. Tromboemboli ve akut koroner olayların tedavisinde UFH’in yerini LMWH’ler almaya başlamıştır. LMWH’Ierin UFH’ya göre avantajları şunlardır: 1- Makrofajlara ve EC’ye daha az bağlandığından plazma yarı ömrü daha çoktur; 2- plazma proteinlerine non-spesifik olarak daha az bağlandığından doza yanıt daha iyi öngörülebilir ve aralıklı sabit dozlar kullanılabilir; 3- trombositlere ve trombosit faktör 4’e daha az bağlandığından heparine bağlı trombositopeni daha az görülür (UFH ile % 10-20) ve 4-kemik kaybı daha azdır. Her ne kadar başlangıçta
LMWH kullanıldığında heparine bağlı trombositopeni insidansı azalırsa da, trombositopeni oluştuğu zaman LMWH preparatıarı arasında antikor çapraz reaksiyonu %75’den fazladır. Subkutan ve ağırlığa göre ayarlanmış dozlarda kullanıldıkları zaman bütün LMWH preparatıarı (dalteparin, enoksaparin, nadroparin ve tinzaparin) DVT profilaksisinde, komplike olmayan DVT’nin ve semptomatik PE’nin tedavisinde UFH kadar etkili ve güvenlidir. Aslında komplike olmayan DVT’nin LMWH ile ayaktan tedavisi, iv. UFH tedavisi için hastaneye yatırılma ile karşılaştırıldığında, tedavinin sonucunu değiştirmeden önemli bir maliyet azalması sağlar. Doz-yanıt eğrisi öngörülebilir olduğundan birçok çalışmada LMWH tedavisinin izlenmesine gerek görülmemiştir. LMWH tedavisi PTT’yi uzatmaz, bu nedenle gerektiğinde anti-Xa düzeyleri ile izlenir. Pik anti-Xa düzeyleri sc. LMWH enjeksiyonundan 3-5 saat sonra oluşur ve uygulanan doza göre değişir. Örneğin 4000 U enoksaparinin sc. enjeksiyondan 4 saat sonra ortalama 0.4 U/mL’lik bir anti-Xa pik konsantrasyonu görülür ve enjeksiyondan 12 saat sonra da plazmada anlamlı bir anti-Xa aktivitesi devam eder. UFH tedavisinde olduğu gibi LMWH’dan varfarine geçiş için 2-3 gün süreyle terapötik düzeyde INR değerleri gerekir. Varfarin halen uzun süreli antikoagülasyon ve trombüsün erken tekrarının önlenmesinde en etkin tedavidir. VTE’nin ortaya çıkışından ve bunu izleyen heparin tedavisinden sonraki 24 saat içinde varfarin başlanmalıdır. Varfarinden saatler sonra faktör VII hızla düştüğünden protrombin zamanı uzar; ancak K vitaminine bağımlı diğer faktörler de (II, IX ve X) düşmeden varfarinin antikoagülan etkisi başlamaz. Terapötik varfarin antikoagülasyonu için genellikle ilk 2-3 günde 5 mg/gün olarak başlanılan 4-5 günlük yeterli bir varfarin dozuna gereksinim vardır. UFH veya LMWH en az 4 günlük bir tedavi ve en azından birbirini izleyen 2 gün 2.0-3.0 arasında bulunan INR değerlerinden sonra kesilebilir. Varfarinle antikoagülasyonda uzun süreden beri devam eden bir sorun, yaklaşık aynı boyutlardaki değişik insanlara aynı doz verildiği halde çok farklı INR yanıtları elde edilmesidir. Varfarini metabolize eden ve temizleyen enzimlerdeki genetik farklılıklar kısmen varfarine olan duyarlılıktaki varyasyonun nedeni olabilir. Varfarinle güvenli bir idame tedavisi dozajı sağlayabilmek için, son zamanlarda hastaları enzim haplotiplerine göre sınıflama çalışmalarına başlanmıştır. INR ile değerlendirilen varfarin dozu hastada tromboemboliye neden olan predispozan şartlara bağlıdır. Bilinen bir risk faktörü olmayan hastalarda komplike olmayan DVT tedavisinde INR’nin 3.0’ü geçmesi gerekmemesine karşın APA sendromlu hastalarda tekrarlayan trombozların proflaksisinde INR değerleri 3.0-4.0 arasında olmalıdır.
Varfarin tedavisinin süresi VTE’nin durumuna, kanama riskine ve olayın tekrarlama potansiyeline bağlıdır. Genelolarak varfarinle antikoagülasyon ne kadar uzun yapılırsa tekrar olasılığı o kadar azalır. Kısa süreli (6 hafta) varfarin tekrarı önlemede uzun süreli (6 ay) tedavi kadar etkili değildir. Ortopedik cerrahi gibi belirgin geçici risk faktörü olan hastalarda kısa süreli tedavi ile de nüks riski az olmasına karşın, idiyopatik tromboembolizmi olan kişilerde 3-6 aylık varfarin tedavisinden sonra bile anlamlı oranda nüks görülür. Faktör V Leiden gibi kalıtsal hiperkoagülabilite hastalığı olan kişilerde yaşam boyunca PE riski fazladır. Bazı çalışmalarda uzun süreli tedavide hafif kanamalar olduğu görülmüştür. Bu durumda tromboz tekrarlama insidansındaki azalma nedeniyle tedaviye devam edilebilir. Faktör V Leiden mutasyonu gibi kalıtsal trombofili varlığında varfarin tedavisine daha da uzun bir süre devam edilmesi gerekebilir. Bu durumda kişide bulunan başka hastalıklar veya venöz tromboza predispozan faktör olabilecek diğer etkenler de göz önüne alınmalıdır. Varfarin kesildikten sonra tekrarlayan venöz trombozu olan hastalarda, tromboz riskini arttıran herhangi bir neden olmasa bile, uzun süreli antikoagülasyon yapılmalıdır. Belirli hasta altgruplarında varfarin tedavisinin devam süreleri gösterilmiştir. Varfarin teratojen olduğundan, doğurma çağındakj kadınlarda kullanılması gerektiğinde etkili bir doğum kontrolü uygulanmalıdır. varfarin tedavisi sırasında kanama oluşturan veya oluşturmayan terapötik düzeyden yüksek INR değerleri sıklıkla görülür. Orta dereceli INR yüksekliği (>5) ile kanamasız veya hafif kanamalı olgularda varfarinin kesilmesi ve soma daha düşük bir idame dozu ile devam edilmesi yeterli olabilir. INR değeri daha yüksek olan (5 - 9) ancak ciddi kanaması olmayan hastalarda varfarin kesilir ve terapötik INR düzeyi elde edilinceye kadar düşük doz (1.0-2.5 mg/gün) oral K-vitamini verilir. Gastrointestinal fonksiyon bozukluğu olan hastalarda K vitamini parenteral olarak da kullanılabilir. Ciddi aktif kanama ve yüksek INR değeri bulunan olgularda, özellikle kanamayı durdurmak için cerrahi müdahale de gerekecekse, K-vitamini ve plazma kombinasyonu INR değerini hızla düzeltir. Serbest varfarin düzeyinin yükselmesine neden olan ilaçların birlikte kullanımına bağlı olarak da INR yükselebilir. Antikoagülasyonun komplikasyonu olarak kanama görüldüğü zaman, gelecekte de kanama riski olabileceği göz önünde tutulmalı ve hastada antikoagülasyon yerine IVC filtrelerinin kullanımı düşünülmelidir.

Gebelik sırasında ve post-partum devrede DVT ve PE riski gebe olmayan bir kadına göre 5 kat artmıştır. Gebelik, anlamlı venöz staz ve prokoagülan faktörlerde (fibrinojen ve vWF) değişikliklerle bağlantılı bir hiperkoagülabilite durumudur. Gebelik ve lohusalık döneminin herhangi bir anında DVT oluşabilir. Gebelik sırasında da venöz trombozun en güvenli tedavisi hem UFH hem de LMWH heparinerdir. Bunlar plasentayı geçmez; varfarin ise plasentayı geçerek karakteristik bir fetal embriyopati yapar. Varfarin ayrıca fetal hemorajiye ve abruptio plasenta’ya neden olduğundan gebelik sırasında kullanılmamalıdır. Gebelikde oluşan DVT veya PE 5-10 gün süreyle i.v. UFH ile tedavi edilmeli, daha sonra tedavi 12 saatte bir 20.000 U s.c UFH ile sürdürülmeli ve heparin dozu enjeksiyondan 6 saat sonra PTT değeri başlangıç değerin 1.5 katından fazla olacak şekilde ayarlanmalıdır. Bir başka alternatif de günde 1-2 kez sc. yapılan LMWH ile tedavidir. Bu tedavi sırasında PTT değerinin izlenmesine gerek yoktur. Anlamlı bir morbidite oluşturmayan suprarenal ıve filtreleri de gebelik sırasında başarılı bir şekilde kullanılmıştır. Her ne kadar doğum sırasında kanama riski fazla değilse de, özellikle anti-Xa düzeyleri 0.7 U/mL’nin altında olduğu zaman travay ve doğum sırasında heparin kesilmelidir. Doğum sırasında antikoagülasyonun oluşturduğu başka bir sorun da epidural anestezide spinal hematom riskidir. Epidural girişim sırasında güvenli olan anti-Xa düzeyi bilinmemektedir. Travay ve doğum sırasında PTT uzun ise UFH 'yı nötralize etmek için protamin sülfat kullanılabilir; protamin ile LMWH’nın etkisi ise ancak kısmen (%10) ortadan kaldırılabilir. Doğum sonrasında antikoagülasyon heparin veya varfarin ile yapılabilir; her iki ilaç da emzirme sırasında kontrendike değildir. Anamnezinde DVT veya PE bulunan veya daha önce trombüs oluşmuş APA sendromlu kadınlar tromboemboli riski taşıdıklarından gebe kaldıkları zaman yoğun bir heparin tedavisine tabi tutulmalı; doğum sonrasında ise varfarin ile antikoagülasyona devam edilmelidir. Uzun süreli varfarin tedavisi uygulanan kadınlar (ör: kalp kapak hastalığı için) gebe kalmak iste-dikleri zaman tedavi tam bir antikoagülasyon sağlayacak şekilde UFH veya LMWH ile yapılmalıdır. Doğum sonrasında tekrar varfarin tedavisine geçilebilir.
Operasyon geçirmesi gereken hastalarda antikoagülasyon sık rastlanan bir klinik problemdir. Bu durumda ana prensip cerrahi girişim esnasında ve hemen sonrasında yeterli hemostaz sağlayabilmek ve özellikle cerrahi girişimin kendisi göreceli bir hiperkoagülabilite durumu oluşturduğundan post operatif dönemde antikoagülasyona yeniden ve olabildiğince erken başlamaktır. Kısa bir süre « 1 ay) antikoagülasyon uygulanacak hastalarda elektif cerrahi girişimler ertelenmelidir. Eğer bu hastalarda girişimi erteleme olanağı yoksa antikoagülasyonun kesilmesi ve ıve filtresi takılması en iyi seçenek olabilir. VTE için uzun süreli antikoagülasyon uygulanan hastalarda genellikle preoperatif heparin uygulanmaz; varfarin ameliyattan en az 4 gün önce kesilmeli ve INR’nin tedricen düşerek ameliyat için güvenli bir düzeyolan [Sin altına inmesi sağlanmalıdır. Postoperatif dönemde varfarin ile terapötik INR düzeyleri sağlanıncaya kadar antikoagülasyon için iv. heparin güvenle kullanılabilir. Bu tedavi önerileri her hastaya göre bireyselolarak uyarlanmalıdır. Arteryel tromboembolik hastalığı bulunan kişilerde cerrahi girişim anına kadar ve hemen sonrasında heparin tedavisi gerekebilir. Buna karşın yüksek hemoraji riski nedeniyle major cerrahi girişimlerden hemen sonra heparin tedavisi kontrendike olabilir; bu durumda antikoagülasyon için 12- 24 saat beklemek gerekebilir.