Neoplazilerin önemi eninde sonunda, hastalar üzerindeki etkilerinden kaynaklanır. Malign tümörler doğal olarak yaşamı, benign tümörlerden daha fazla tehlikeye sokar ama benign olsa bile herhangi bir tümöre, morbidite ve mortalite eşlik edebilir. Aslında gerek iyi gerekse malign tümörler bulundukları yer ve komşu oluşumlar üzerindeki etkileri, hormon sentezi veya paraneoplastik sendromlarm gelişmesi gibi fonksiyonel aktiviteleri, komşu yüzeylere ülserleşen tümörlerin, kanama ve enfeksiyona yol açabilmesi, rüptüre veya infarktüse bağlı semptomlar ve kanser kaşeksisi nedeniyle sorunlara yol açabilir. Aşağıda tümörün konak, kanserin derecelendirilmesi ve evrelendirilmesi ve neoplazilerin laboratuar tanısı üzerindeki etkileri anlatılmaktadır.
Tümörün Konak Üzerindeki Etkileri
Bulundukları yer, hem benign hem malign tümörlerde son derece önemlidir. Küçük (1 cm çapındaki) bir hipofiz adenomu, çevresindeki normal hipofizi sıkıştırıp tahrip edebilir ve hipopituitarizme neden olabilir. Böbrek arteri duvarında yer alan 0.5 santimetrelik bir leiomiyom, kan dolaşımını engelleyerek böbrek iskemisine ve hipertansiyona yol açabilir. Koledok kanalındaki yine aynı büyüklükte bir karsinom safra yolunun ölümle sonuçlanan tıkanıklığına neden olabilir.
Endokrin salgı bezlerinden kaynaklanan benign veya malign tümörler, hormon üretebilmektedir. Pankreastaki Langerhans adacıklarında ortaya çıkan adenom ve karsinomlar, bazen ölümle sonuçlanabilen hiperinsülinizm nedeni olabilir. Bunun gibi, adrenal korteksteki bazı adenom ve karsinomlar, hastada önemli etkilere yol açan kortikosteroidler (örneğin sodyum tutulması, hipertansiyon ve hipokalemiye neden olan aldosteron) üretir. Bu gibi hormonal aktivitelerin iyi diferansiye benign tümörlerde karşımıza çıkma olasılığı, aynı yerdeki malign tümörlerdekin- den daha fazladır. Bir tümör yakınındaki bir yüzeye ülserleşerek kanama veya sekonder enfeksiyon nedeni olabilir. Barsak lümenine doğru büyüyen benign veya malign neoplaziler, peristaltik hareketlere kapılarak intususepsiyona, barsak tıkanmasına veya enfarktüse yol açabilir.

Kanser Kaşeksisi
Birçok kanser hastasında vücuttaki yağ ve yağsız vücut kütlesi, şiddetli dermansızlık, iştahsızlık ve anemi eşliğinde giderek azalır ve kaşeksi adı verilen duruma yol açabilir. Kaşeksinin şiddeti, kanserin büyüklüğü ve yayılmasıyla bir bakıma bağlantılıdır. Ancak kaşeksinin nedeni, tümörün besin maddelerine ihtiyaç duyması değildir. Kaşeksili hastalarda çoğu zaman iştahsızlık varsa da elimizdeki güncel kanıtlar kaşeksinin, hastanın yetersiz beslenmesinden çok, tümör ve konak tarafından üretilen, sito- kinler gibi çözünür faktörlerin sonucu olduğunu işaret etmektedir. Yetersiz beslenmeye rağmen kanser hastalarının kalori tüketimi ve bazal metabolizması yüksektir. Bu durum, açlık sırasında gelişen uyum yanıtında görülenin tam tersidir. Söz konusu metabolik anormalliklerin temeli, tam olarak anlaşılmış değildir. Makrofajlar tarafından tümör yanıtı olarak ya da bizzat tümör hücreleri tarafından üretilen tümör nekroz faktör’ün (TNF), kaşekside medyatör rolü oynadığından şüphelenilmektedir. TNF, iştahı bastırır ve lipoprotein lipazm etkisini, dolayısıyla yağ asitlerinin lipoproteinlerden serbest kalmasını inhibe eder. Ayrıca kanser hastalarının serumunda, iskelet kasındaki proteinleri ubikuitin-proteozom yoluyla parçalayan ve proteoliz-başlatan faktör adlı, protein mobilizasyo- nuna yol açan bir faktör bulunmuştur. Lipolitik etkiye sahip daha başka moleküller de bulunmuştur. Kaşeksinin, altta yatan nedeninin uzaklaştırılması, yani tümörün çıkarılması dışında, tatmin edici bir tedavisi yoktur.
Paraneoplastik Sendromlar
Kanserli hastalarda görülen ve tümörün lokal ya da uzaklara yayılmasıyla veya tümörün kaynaklandığı dokuda normal olarak bulunmayan hormonlarla açıklanamayan semptom kompleksleri, paraneoplastik sendromlar olarak adlandırılmaktadır. Kanser hastalarının %10-%15’inde karşılaşılan bu sendromlarm klinik olarak tanınması, çeşitli nedenlerden dolayı önemlidir:
• Bu gibi sendromlar gizli bir neoplazinin en erken belirtisini temsil edebilir.
• Bu sendromlarm görüldüğü hastalardaki patolojik değişikliklere önemli klinik hastalıklar, hatta ölüm eşlik edebilir.
• Sendromdaki semptom kompleksi, metastatik hastalığı taklit ederek tedavide karışıklığa neden olabilir.
Paraneoplastik sendromlar çeşitlidir ve farklı birçok tümöre eşlik eder. Hiperkalsemi, Cushing sendromu ve bakterilere bağlı olmayan trombotik endokardit; en fazla görülen paraneoplastik sendromlardır; bunların ve diğer paraneoplastik sendromlarm en sık eşlik ettiği kanserler, akciğer ve meme kanserleri ile hematolojik malignitelerdir. Kanser hastalarında hiperkalsemi çok sayıda faktöre bağlı olarak gelişebilirse de buna yol açan en önemli mekanizma, tümör hücrelerinin paratiroid hormonuyla ilişkili bir protein (parathyroid hormone-related protein) (PTHrP) sentez etmesidir. Tümörlerden kaynaklanan TGF-a, oste- oklastları aktive eden polipeptid yapısındaki bir faktör ve D vitamininin aktif formu, hiperkalsemiye yol açabilen diğer nedenlerdendir. Kemik kanserinin yaygın osteolitik metastazları da bir diğer olası hiperkalsemi mekanizmasıdır ama iskelet metastazlarının yol açtığı hiperkalsemi, paraneoplastik bir sendrom değildir. Paraneoplastik sendrom olarak Cushing sendromu genellikle; küçük hücreli akciğer kanseri gibi bazı kanser hücrelerinde ektopik olarak ACTH veya ACTH-benzeri polipeptidler üretilmesiyle bağlantılıdır. Bazen bir tümör, eşzamanlı olarak birkaç paraneoplastik sendroma neden olabilir. Örneğin bronkojenik karsinomlar ACTH, antidiüretik hormon, paratiroid hormonu, serotonin, insan koriyonilc gonadotropini gibi hormonlar ya da bu hormonların etkilerine sahip olan diğer biyoaktif maddeler salgılayabilir. Paraneoplastik sendromlar bazen kendilerini, venöz tromboza ve non-bakteriyel trombotik endokardite neden olan hiperkoagülabiliteyle de gösterebilir. Akciğer karsinomu olan hastaların parmaklarındaki çomaklaşma ve hipertrofik osteoartropati, diğer belirtiler arasındadır. Bunların dışında kalan paraneoplastik sendromlardan ve belirtilerinden, vücuttaki çeşitli organların kanserleri anlatılırken söz edilmektedir.
Kanserin Derecelendirilme ve Evrelendirilmesi
Belirli bir neoplazinin klinikte ne kadar agresif davrandığını ve herhangi bir hastada, görünürdeki kapsamının ve yayıldığı alanın ne olduğunu belirlemek amacıyla kullanılacak yöntemler, prognozun hatasız olarak öngörülmesinde ve çeşitli tedavi protokolleriyle elde edilen kesin sonuçların karşılaştırılmasında gereklidir. Örneğin, yalnızca tiroidde lokalize olan son derece küçük, ileri derecede diferansiye tiroid adenokarsinomlarındaki tedavi sonuçları ile boyundaki organları invaze etmiş, ileri derecede anaplastik tiroid kanserlerinde elde edilecek; tedavi sonuçları büyük olasılıkla farklı olacaktır.
Kanserlerin derecelendirilme sindeki (grading) amaç, saldırganlığının veya malignite düzeyinin, tümör hücrelerinin sitolojik diferansiasyonunu ve tümördeki mitotik bölünme sayısını temel alarak belirlemektir. Böylece kanserler, anaplazinin gittikçe arttığını göstermek üzere T, IT, III. veya IV. derece olarak sınıflandırılabilir. Derecelendirme kriterleri, her çeşit neoplazide farklıdır ve burada ayrıntılı olarak belirtilmeyecektir. Kanserin derecesini belirlemek amacıyla kullanılabilecek kriterlerin kesin olmaması bazen; “vasküler veya lenfatik invazyon bulgusu olmayan, iyi diferansiye adenokarsinom” veya “yaygın vasküler invazyon eşliğindeki ileri derecede anaplastik sarkom” gibi, açıklayıcı tanımlamalar kullanılmasını gerektirmiştir.
Kanserlerin evrelendirilmesinde primer lezyonun büyüklüğü, bölgesel lenf nodlarma yayılma derecesi ve metastaz yapmış olup olmaması temel alınır. Bu değerlendirmede genellikle, klinik ve radyolojik (bilgisayarlı tomografi ve manyetik rezonans [MR]) değerlendirme, bazen de cerrahi eksplorasyon sonuçları kullanılır. Günümüzde;TNM (T, primer tümör; N, bölgesel lenf nodu tutulumu; M, metastazları) sistemi ve AJC (American Joint Committee) sistemi olmak üzere 2 evreleme yöntemi kullanılmaktadır. TNM sisteminde, Tl, T2, T3 ve T4 primer lezyonun gittikçe artan büyüklüğünü; NO, Nl, N2 ve N3 gittikçe ilerleyen lenf nodu tutulumunu gösterir; M0 ve Mİ ise sırasıyla, uzak metastazların mevcut olup olmadığını yansıtır. AJC yönteminde kanserler; primer lezyonun büyüklüğüne, lenf nodlarma yayılmanın ve uzak metastazların mevcut olup olmamasına göre 0 ve IV arasında evrelendi- rilmektedir. Bu iki evreleme sisteminin örnekleri, daha sonraki bölümlerde verilmektedir. Evrelemenin klinik değerinin, derecelendirmeden daha fazla olduğunun kanıtlandığını vurgulamak gerekir.
Kanserde Laboratuvar Tanısı Morfolojik Yöntemler
Çoğu durumda, kanserde laboratuvar tanısı zor değildir. Benign malign spektrumunun iki ucu, bu bakımdan sorun yaratmaz; ancak bu iki uç arasında, kesin tanı koyabilmek için ihtiyatlı davranılması gereken, belirsiz bir durum vardır. Doktorlar, kanser tanısına yaptıkları katkıyı küçümseme eğilimindedir. Oysa klinik ve radyolojik veriler patolojik tanı açısından son derece değerlidir. Deride veya mukozada radyasyon etkisiyle meydana gelen değişiklikler, kanserin neden olduğu değişikliklere benzeyebilir. İyileşmekte olan bir kırıktan alman histolojik kesitlerin görünümü, osteosarkomu taklit edebilir. İncelenmesi için teslim alman örnek ne kadar iyiyse, laboratuar tanısı da o kadar iyidir. Bu nedenle alman örnek yeterli olmalı, lezyonu temsil etmeli ve gereken şekilde korunmuş olmalıdır.
Örnek alma amacıyla eksizyon veya biyopsi, ince iğne aspirasyonu ve sitolojik yayma preparat (smear) gibi çeşitli yaklaşımlar kullanılabilir. Eksizyonu mümkün olmayan büyük bir kitleden doku örneği alınırken, kenar kısımların lezyonu temsil etmeme olasılığının, lezyon merkezinde de nekroz gelişmiş olabileceğinin bilincinde olmak gerekir. Kitle oluşturan bir lezyonun tabiatının anlaşılabilmesi için ya da kanser hastasındaki bölgesel lenf nodlarının metastaz yönünden değerlendirilmesi için örnek doku dondurularak incelenebilir (frozen section). Dokunun hızla dondurulduktan sonra kesitin yapıldığı bu yöntem, histolojik değerlendirmenin birkaç dakika içerisinde yapılmasına olanak verir. Söz konusu yöntem deneyimli, becerili eller tarafından uygulandığında konulan tanı doğrudur ama bazen, daha fazla zaman alan rutin yöntemler kullanılarak histolojik ayrıntıların daha iyi görülmesi gerekebilir. Bu gibi durumlarda yetersiz ya da gereksiz bir cerrahi girişime başvurmak yerine, sakıncalı olmasına rağmen birkaç gün beklemek daha iyi olabilir.
Tümörlerde ince iğne aspirasyonu, yaygın olarak kullanılan diğer bir yaklaşımdır. Bu yaklaşımda kitle şeklindeki lezyondan iğne aspirasyonuyla elde edilen hücrelerden hazırlanan yayma preparat (smear), sitolojik olarak incelenir. Bu yaklaşım en çok meme, tiroid, lenf bezleri ve tükrük bezlerinde kolayca ele gelen lezyonlarda kullanılmaktadır. Günümüzdeki görüntüleme teknikleri yöntemin; karaciğer, pankreas ve pelvisteki lenf nodları gibi daha derinlerdeki oluşumlarda da uygulanmasına olanak vermektedir. Yöntem, cerrahi girişime ihtiyaç bırakmaz ve dolayısıyla da böyle bir girişime eşlik edebilecek riskleri ortadan kaldırır. Alman örneğin küçük boyutlu olması ve örnek alınma sırasında yapılabilecek hatalar gibi bazı zorluklarının olmasına rağmen ince iğneyle aspirasyon deneyimli ellerde çabuk uygulanan, güvenilir ve faydalı bir yaklaşımdır.
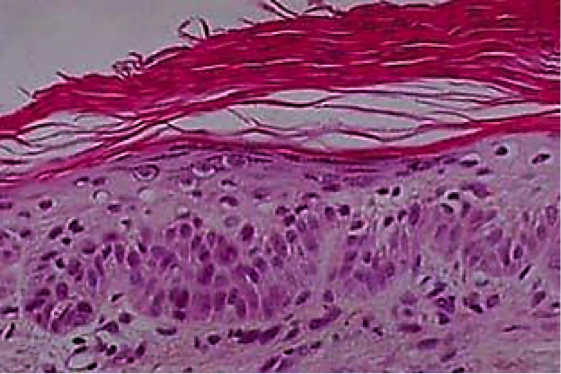
Sitolojik (Papanicolaou) yayma preparat (smear), kanser tanısında kullanılabilen diğer bir yöntemdir. İlk yıllarda bu yöntem, serviks uteri karsinomunun çoğu zaman in situ aşamadayken tanısının konulması amacıyla yaygın olarak kullanılmıştır, ancak şimdilerde endometrium karsinomu, bronkojenik karsinom, mesane ve prostat tümörleri ve mide karsinomları gibi kuşkulu durumların incelenmesi; batın, plevra ve eklemdeki sıvılarda ve beyin-omuri- lik sıvısında tümör hücreleri aranması amacıyla ve daha seyrek olarak da diğer neoplazilerin değerlendirilmesinde de kullanılmaktadır. Diğer hücrelere göre daha az kohesiv olmaları (hücrelerarası bağlantıların daha zayıf olması) nedeniyle neoplastik hücreler, sıvılara ve salgılara dökülebilir. Bu hücreler, bir tümörün kaynağını ortaya çıkaracak anaplastik özellikleri bakımından incelenir. Servikal kanser kontrolünün tatmin edici düzeyde sağlanmış olması, sitolojik yöntemin değerinin kanıtıdır.
İmmünhistokimya, rutin histolojik incelemenin güçlü bir yardımcısıdır. Sitokeratinin, peroksidazla işaretlenmiş spesifik monoklonal antikorlar kullanılarak gösterilmesi, büyük hücreli lenfoma tanısından çok, indiferansiye karsinom tanısı lehinedir. Bunun gibi, metastazlarda immü- nohistokimyasal boyamayla PSA (prostat-spesifik antijen) gösterilmesi, kesin olarak prostat tümörünü işaret eder. Ostrojen reseptörlerinin immünohistokimyasal olarak ortaya konulması, meme kanserindeki tedavi girişiminin yönünü belirler. Akım sitometrisi (flow cytometry) rutin olarak, lösemilerin ve lenfomalarm sınıflandırılmasında başvurulan bir yöntemdir. Bu yöntemde, hücredeki yüzey moleküllerine ve diferansiasyon antijenlerine karşı oluşturulan floresan antikorlar, malign hücrelerin fenotipini belirlemek amacıyla kullanılır.
Tümör Belirteçleri
Tümörlere eşlik eden enzim, hormon veya diğer tümör belirteçlerinin kan düzeylerini gösteren biyokimyasal analizler, kanserin kesin tanısında kullanılamaz ama faydalı tarama testleri olarak ve bazen de tedaviye alman yanıt miktarının veya hastalığın nüks ettiğinin belirlenmesinde kullanılabilir. Bu analizlerin kullanılmasına, diğer bölümlerde ele alman birçok spesifik neoplazi çeşidinin anlatılması sırasında değinildiğinden, burada yalnızca birkaç örnek vermekle yetinilmektedir. Prostat kanseri taramalarında kullanılan PSA, klinik uygulamada en sık ve en başarılı şekilde kullanılan tümör belirteçlerinden biri olabilir. Kandaki PSA düzeyi yüksek bulunduğunda, prostat karsinomundan şüphe edilebilir. Ancak diğer bütün tümör belirteçlerinin uygulanmasına eşlik eden sorunlar, PSA taramalarında da söz konusu olmaktadır. PSA düzeyleri prostat karsi- nomunda yükselmiş olabilir ama benign prostat hiperplazisinde de aynı bulguyla karşılaşılabilir. Dahası, hastada prostat kanseri olmadığını kesin olarak söylememizi sağlayacak herhangi bir PSA düzeyi yoktur. Böylece, PSA testinin hem spesifitesi, hem duyarlılığı düşüktür. Ancak PSA düzeyi, prostat kanserinden sonra geriye kalmış olabilecek hastalığın veya prostat kanserinin tekrarladığının gösterilmesinde son derece önemlidir. Kolon, pankreas, mide ve meme kanserleri tarafından yolk sac kalıntılarında ve bazen de teratokarsinomlarda ve embryonal hücreli karsinomlarda üretilen alfa fetoprotein, klinik uygulamada zaman zaman kullanılan diğer tümör belirteçlerin- dendir. Ne yazık ki PSA gibi bu iki belirteç de, neoplastik olmayan çeşitli durumlarda da üretilebilmektedir. Böylece CEA ve alfa fetoprotein analizlerinin de erken kanser tanısındaki hem spesifitesi, hem duyarlılığı düşüktür. PSA taramaları gibi bunlarda, eksizyon sonrası gelişebilecek nükslerin ortaya çıkarılmasında özellikle faydalıdır. Tümörün başarılı rezeksiyonu, bu belirteçlerin serumdan kaybolmasıyla sonuçlanır; belirteçlerin serumda tekrar ortaya çıkmaları ise, hemen her zaman için sonun başlangıcını belirtir. CEA ve alfa fetoprotein ayrıntılı olarak anlatılmaktadır.
Moleküler Tanı
Tümör tanısında ve davranışlarının tahmin edilmesinde kullanılmakta olan moleküler tekniklerin sayısı, gittikçe artmaktadır.
• Malignite tanısı: Gerek T, gerekse B hücrelerindeki antijen reseptörü genlerinin düzenlenmeleri benzersiz olduğundan; T hücresi reseptörlerinin veya immünoglo- biilin genlerinin polimeraz zincir reaksiyonu (polymerase chain reaction-PCR) kullanılarak ortaya konulması, monoklonal (neoplastik) ve poliklonal (reaktif) pro- liferasyonlar arasında ayırım yapılmasına izin vermektedir. Çok sayıda hematopoetik neoplazi, ayrıca birkaç solid tümör belirli translokasyonlara sahip olduklarından bunların ortaya konulması, tanı konulmasını da sağlayabilir. Örneğin Ewing sarkomunda ve çeşitli lösemilerle lenfomalardaki karakteristik translokasyonla- rın ortaya konulmasında FISH (floresan in situ hibridi- zasyon) veya PCR analizi kullanılabilir (Bölüm 6). BCR- ABL transkripsiyon ürünlerinin PCR kullanılarak ortaya konulması, kronik miyeloid lösemide moleküler tanıya olanak vermektedir.
Prognoz ve davranış: Belirli genetik değişikliklere karanlık bir prognoz eşlik ettiğinden bunların varlığı, hastada daha sonra uygulanacak tedaviyi belirler. HER2/NEU ve NMYC genleri gibi meme kanserlerinde ve nöroblas- tomlarda, prognoz ve tedavi bilgileri sağlayan onkojen- lerde artış meydana gelmesi, FISH ve PCR yöntemleriyle gösterilebilir.
• Minimal rezidüel hastalığın ortaya konulması: Tedaviden sonra geriye kalmış olabilecek minimal rezidüel hastalığın ortaya konulması, moleküler tekniklerin kullanılmaya başlandığı yeni bir uygulamadır. Örneğin BCR- ABL transkripsiyon ürünlerinin PCR analiziyle gösterilmesi, kronik miyeloid lösemi tedavisi gören hastalarda mevcut olabilecek minimal rezidüel hastalığı gösterebilir. İlerlemiş bütün tümörlere hem dolaşımdaki sağlam tümör hücrelerinin, hem tümör ürünlerinin (örneğin tümör DNA’smm) eşlik ettiğinin anlaşılması; tümör yükünün duyarlı kan testleri aracılığıyla izlenmesinin ilgi çekmesiyle sonuçlanmıştır.
• Kansere olan herediter yatkınlığın tanısı: BRCA1 gibi, tümör baskılayıcı genlerin germline mutasyonu, bir hastadaki belirli kanser tiplerinin gelişme riskini artırır. Böylece söz konusu mutant allellerin ortaya konulması hastaya ve doktora, agresif bir tarama protokolünü planlama olanağı ve ayrıca, profilaktik cerrahi girişim fırsatı verebilir. Ayrıca, hastanın risk altındaki akrabalarına genetik danışmanlık hizmeti verilmesine olanak sağlar.
- Terapötik karar verme süreci: Spesifik mutasyonları doğrudan hedef alan tedaviler gittikçe daha çok geliştirilmektedir. Bu mutasyonlarm bir tümörde saptanması, hedefe yönelik tedaviyi yönlendirebilir. Hedef alınabilecek mutasyonlarm, morfolojik kategori sınırlarının dışına taştığını gösteren kanıtlar ele geçmektedir. Örneğin; önceleri bir T hücreli lenfoma alt-takımında tanımlanmış olan ALK kinaz; küçük hücreli dışı akciğer kanseri ve nöroblastom hastalarının küçük bir yüzdesinde de bulunmuştur. ALK mutasyonlarmm mevcut olduğu akciğer kanserlerinin ALK inhibitörlerine yanıt verdiğini; diğer akciğer kanserlerinin ise bu inhibitörlere yanıt vermediğini gösteren klinik çalışmalar FDA’nm bu in- hibitörlerin “ALK-mutant” akciğer kanseri olan hastalarda kullanılmasını onaylamasıyla sonuçlanmıştır. Moleküler düzeyde ısmarlanmış tedavilere yalcın zamanlarda eklenen etkileyici bir diğer örnek, melanomda söz konusudur: BRAF’teki serin/treonin lcinazda yer alan amino asit 600’deki glutamatm yerine valin geçmesi (V600E mutasyonu), tümörün BRAF inhibitörlerine iyi yanıt vermesini sağlamakta; bu mutasyonu taşımayan melanomlar ise söz konusu inhibitörlere hiç yanıt vermemektedir. V600E mutasyonunun kolon kanserlerinin bir alt-takımında, belirli tiroid kanserlerinde, tüylü hücreli lösemilerin tümünde ve Langerhans hücresi histiyositozunda bulunması, ilginçtir. Morfolojileri ve kökenleri birbirlerinden farklı olmalarına rağmen bu tümörler; ortak bir büyüme öncesi (pro-growth) yolundaki aynı onlcogen lezyonları paylaşmaktadır.
Tümörlerin Moleküler Profillerinin Çıkarılması
Tümörlerin moleküler profilinin incelenmesi, hem mRNA düzeyinde, hem de nükleotid dizilemesi ile yapılabilir.
Ekspresyon Profilinin Çıkarılması
Bu teknik binlerce genin ekspresyon düzeylerinin eşzamanlı olarak ölçülmesine olanak vermektedir. Gen yonga teknolojisi olarak adlandırılan bu teknolojinin ilkeleri, gösterilmekte ve burada kısaca anlatılmaktadır. mRNA’larm komplementer DNA (cDNA) kopyaları, floresan olarak işaretlenmiş nükleotidlerle in vitro sentez edilir. Floresansla işaretli cDNA şeritleri, silikon bir yonga (çip) gibi katı bir destek üzerindeki nükleotid sırasma-spesifik DNA problarıyla hibridleştiri- lir. Bir santimetrekarelik böyle bir yonga, sıralar ve sütunlar şeklinde dizili binlerce gen içerebilir. Hibridleştirme sonrası her lekeden gelen floresan sinyaller, yüksek çözünürlüklü bir lazer taramasıyla belirlenir. Her lekenin floresan yoğunluğu, o lekeyle hibridleştirilen cDNA’nm sentezinde kullanılan orijinal mRNA’nm elcspresyon düzeyiyle orantılıdır. Böylece her lekede, binlerce genin ekspresyon düzeyi elde edilir ve biyoinformatik araçlarla, farklı örneklerdeki gen ekspresyon düzeyleri karşılaştırılabilir. Özü itibarıyla, analiz edilen her dokunun moleküler profili çıkarılır.
Bu çeşit analiz; farklı hastalara ait, fenotipik bakımdan aynı olan, büyük B hücreli lenfomalarm, gen ekspresyonu ve sağkalım oranları bakımından birbirlerinden farklı olduğunu ortaya çıkarmıştır. Şimdilerde benzer yaklaşımlar, meme kanserleri ve melanomlar gibi diğer kanserlerde de araştırılmaktadır.
Tüm Genom Dizilemesi
Yeni nesil nükleotid dizileme teknolojilerinde kaydedilen ilerleme ve gelişmeler, tümörlerin daha derinlemesine analiz edilebileceğini vaad etmektedir. Şimdilerde söz konusu teknolojilerde kaydedilmiş olan ilerleme, mikro-işlemcüere ait, tanınmış Moore yasasını geride bırakmaktadır. Bir tümörde tüm genomun nükleotid sıralanmasının belirlenmesi, birkaç yıl önce aylarca zamana ve milyonlarca dolara mal olmaktaydı; günümüzde ise birkaç gün içerisinde, birkaç bin dolar harcanarak gerçekleştirilebilmektedir. Tüm tümör genomundaki nükleotid sıralanmaları aynı hastaya ait normal genomdakilerle karşılaştırıldığı zaman, tümörde mevcut bütün somatik değişiklikleri ortaya çıkarabilir. Tümörlerin genetik analiziyle yakın zamanlarda elde edilen sonuçlar, her bir tümörün bir avuç dolusu somatik mutasyonla (özellikle çocukluk dönemindeki lösemiler) on binlerce mutasyon arasında değişebüen sayılarda mutasyonlar içerdiğini ve mutasyon yükünün en fazla, muta- jenlere maruz kalınmasına eşlik eden, akciğer kanseri ve deri kanseri gibi tümörlerde bulunduğunu ortaya çıkarmıştır. Bunların arasında iki tip mutasyon vardır: Hücrelerin proliferasyon, diferansiasyon ve homeostazının normal kontrolünü altüst edenler ve hücre fenotipini etkilemeyenler. Birinci tip mutasyonlar, neoplastik süreci yönlendirebilen ve bu nedenle de tedavi hedefi olabilecek mutasyonlar olmaları nedeniyle yönlendirici (driver) mutasyonlar olarak adlandırılır. İkinci tipte yer alan ve sayıları yönlendirici mutasyonlardan çoğu zaman daha fazla olan mutasyonlar genellikle, genomun kodlama yapmayan bir bölümünde yer alan veya büyüme üzerinde etkisiz kalmaları nedeniyle ne avantaj, ne de dezavantaj sağlayan mutasyonlardır; bunlar yolcu (passenger) mutasyonlar olarak adlandırılır. Yolcu mutasyonlar, kanser hücrelerindeki genomların stabil olmamasından kaynaklanır ve yalnızca “lâf olsun diye” mevcuttur.
Yönlendirici mutasyonlar genelde tekrarlar ve belirli bir kanseri olan hastaların önemli bir bölümünde vardır. Böylece, örneğin BCR-ABL füzyon genleri kronik miyeloid lösemi hastalarının hepsinde vardır ve füzyon proteini, ilaçlar için mükemmel bir hedeftir. Ancak yönlendirici mutasyonlar, belirli bir tümör tipinin yalnızca bir alt-takı- mında mevcut olabilir. Örneğin, küçük hücreli-dışı akciğer kanserlerinin %4 kadarında bir EML4-ALK tirozin kinaz füzyon geni vardır; daha önce de anlatıldığı gibi bu hastalar, ALK inhibitörlerine iyi yanıt verir. Bazı yolcu mutasyonlarm ilaç direncinde yine de önemli rol oynayabilmesi, bir diğer sorundur. Örneğin kronik miyeloid lösemi tedavisinde imatinibe direnç sağlayan mutasyonlar, tedavi başlangıcından önce seyrek klonlar halinde bulunan yolcu mutasyonlar şeklindedir. Güçlü bir selektif avantaj sağlamaları nedeniyle bu mutasyonlar, ilaç tedavisine başlandığında yolcu mutasyondan yönetici mutasyona dönüşür; kanser hücrelerindeki genom instabilitesinin birçok tümör çeşidinde, benzer senaryolarla direnç tohumlarını attığından şüphelenilmektedir. Dahası bazen, çok sayıda farklı ve nispeten seyrek görülen mutasyonlar, aynı yoluizleyebilir (örneğin apoptoza direnç kazanabilir) ve kanser fenotipine katkı yapabilir. Mutasyonları, kanserin ayırıcı özellikleri yollarını izleme yeteneklerine göre katego- rize etmek, bu nedenle faydalıdır.
Hedef alınacak spesifik mutasyonlar geliştikçe, her bir tümördeki hedef olma potansiyeline sahip tüm mutasyon- larm ortaya konulmasının, tümörlerin kaynaklandığı doku üzerinde odaklanan tedavinin, moleküler lezyonlarm tedavisinde odaklanmasını sağlayacağı umulmaktadır. Bu yaklaşım, tümörlerin sınıflandırılmasındaki ve tedavilerindeki bir görüş değişikliğini temsil etmektedir. Belki de gelecekte, BRAF gibi ortak bir mutas- yon içeren farklı tümör gruplarının, morfolojilerine veya kaynaklandıkları hücrelere göre değil de, BRAF-omalar olarak sınıflandırılmalarına tanık olunması mümkündür